Selentilskud kan være gavnligt som en adjuverende behandling til patienter med mitokondrielidelser. Dette gælder især i mange dele af Europa og Mellemøsten, hvor jorden og fødevarerne har et lavt indhold af selen [Stoffaneller & Morse 2015]. Specifikt har personer med mitokondriel dysfunktion brug for antioxidant- og anti-inflammations-effekterne af selenafhængige selenoproteiner [Alehagen 2021; Opstad 2022].

Mitokondriel dysfunktion kan defineres som en nedsat kapacitet af cellernes mitokondrier til at omdanne sukker til energi, dvs. cellernes formindskede kapacitet til at generere ATP-energi [Miwa 2022].
Mitokondriel dysfunktion er tæt forbundet med biologisk aldring og med celleældning (ophør af celledeling) [Miwa 2022].
Mitokondriel dysfunktion er også forbundet med øget hvileenergi-forbrug, en tilstand kaldet hypermetabolisme [Sturm 2023].
Mitokondriel dysfunktion er forbundet med telomernedslidning, afkortningen af beskyttelseshætterne på enderne af kromosomerne. Til sidst bliver telomer-nedslidning så alvorlig, at celledeling ikke længere er mulig [Sturm 2023].
HYPERMETABOLISME OG BEHOVet FOR en OPTIMAL SELENSTATUS
Hypermetabolisme er den tilpasning, der sker i celler med nedsat mitokondriefunktion. For at forbedre deres kortsigtede overlevelseschancer reagerer cellerne ved at bruge mere og mere energi, selv i hvile. Imidlertid øger den resulterende hypermetabolisme hastigheden af cellernes aldring betydeligt. Cellerne bruger i bund og grund mere energi, end de er i stand til at generere på grund af den mitokondrielle dysfunktion [Sturm 2023].
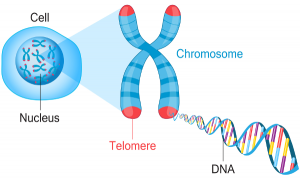
Det er nærmest en faustisk pagt som cellerne med dysfunktionelle mitokondrier tvinges ud i. Ja, hypermetabolismen holder cellerne i gang på kort sigt. Samtidig aktiverer det øgede hvileenergi-forbrug – hypermetabolismen – stressreaktioner og inflammation og nedbryder cellernes telomerer [Sturm 2023].
Biologisk aldring og for tidlig død er uundgåelige i sådanne tilfælde. Det, der sker, er, at cellerne bruger ressourcer på kortsigtet overlevelse, som ellers ville være tilgængelige for processer, der forbedrer en langsigtet overlevelse, f.eks. vedligeholdelse af telomererne [Sturm 2023].
SELENSTATUS OG TELOMERnedslidning
Lad os gennemgå evidensen.
Svensk undersøgelse
I KiSel-10-undersøgelsen gav professor Urban Alehagen og et team af forskere en aktiv behandling bestående af 200 mkg selen og 200 mg coenzym Q10 eller matchende placebo til ældre svenske borgere, gennemsnitsalder 78 år, som havde en lav selenstatus. ved undersøgelsens start – 67,1 mkg/l [Alehagen 2018]. I en delanalyse sammenlignede forskerne leukocyt-telomerlængden ved starten af undersøgelsen og igen efter 42 måneder [Opstad 2022].
De fandt en signifikant mindre afkortning af leukocytternes telomerlængde i den aktive behandlingsgruppe sammenlignet med placebogruppen. Desuden opdagede de, at undersøgelsesdeltagere, der døde senere, havde signifikant kortere telomerer efter 42 måneder end de overlevende. Delanalysen viste, at den mindre telomerforkortning i den aktive behandlingsgruppe var forbundet med en nedsat risiko for kardiovaskulær dødelighed og med en forbedret overlevelse [Opstad 2022].
I tidligere delstudier havde de svenske forskere vist, at den daglige kombination af selen- og Q10-tilskud i fire år havde følgende signifikante effekter [Alehagen 2022]:
- Forbedret hjertefunktion
- Mindsket inflammation og oxidativ stress
- Forbedret endotelfunktion
- Nedsat fibrose
Amerikanske undersøgelser
Forskere målte leukocyt-telomerlængden på 3194 amerikanske voksne over 45 år og sammenlignede telomerlængde-dataene med undersøgelses-deltagernes selenindtag fra kosten. Efter at de havde justeret for potentielle confounders (mulige forstyrrende variabler), fandt forskerne, at hver 20 mkg stigning i kostens selenindtag var forbundet med 0,42 % længere telomerlængde. Undergruppeanalyser afslørede, at kostens selenindtag var signifikant relateret til længere telomerlængde hos kvinder og ikke-overvægtige deltagere, men nåede ikke statistisk signifikans hos mænd og overvægtige deltagere [Shu 2020].
I en undersøgelse af 878 undersøgelsesdeltagere med diabetes, observerede forskere, at der var en lineær sammenhæng mellem selenindtaget fra kosten og telomerlængden hos kvindelige patienter med diabetes. En mindre nedslidning af telomererne var forbundet med et højere selenindtag i området området fra nul til 250 mkg/dag [Gong 2022].
Kinesisk undersøgelse
I en undersøgelse af 746 mor-nyfødte par på Wuhan Children’s Hospital fandt forskerne evidens for, at moderens selenniveau positivt påvirker fostrets telomerlængde. Dette er vigtigt, fordi nyfødtes telomerlængde effektivt kan forudsige levetid og helbredssituation senere i livet [Wang 2022].
Myanmar undersøgelse
En undersøgelse af 408 mor-spædbarn-par indikerede, at selenindtagelse og -status har en beskyttende effekt på telomerforkortning forårsaget af eksponering for tungmetaller som bly og cadmium [Wai 2020].
KONKLUSION: OPTIMAL SELENSTATUS FOR bevaring af telomerer
- Biologisk aldring er en uundgåelig proces. Det er kendetegnet ved mitokondriel dysfunktion, en ubalance mellem skadelige frie radikaler og beskyttende antioxidanter, kronisk systemisk inflammation, telomernedslidning og cellulær senescens [Alehagen 2021].
- Selen via aktiviteten af antioxidant seleno-enzymer reducerer oxidativ stress og inflammation, beskytter mod telomerforkortning og mindsker DNA-skader [Alehagen 2021].
- Et optimalt selenindtag er et indtag, der opretholder serumselenstatus omkring 125 mkg/l [Winther 2020].
Kilder
Alehagen U, Aaseth J, Alexander J, Johansson P. Still reduced cardiovascular mortality 12 years after supplementation with selenium and coenzyme Q10 for four years: A validation of previous 10-year follow-up results of a prospective randomized controlled trial. PLoS One. 2018;13:e0193120.
Alehagen U, Opstad TB, Alexander J, Larsson A, Aaseth J. Impact of Selenium on Biomarkers and Clinical Aspects Related to Ageing. A Review. Biomolecules. 2021 Oct 7;11(10):1478.
Alehagen U, Johansson P, Svensson E, Aaseth J, Alexander J. Improved cardiovascular health by supplementation with selenium and coenzyme Q10: applying structural equation modelling (SEM) to clinical outcomes and biomarkers to explore underlying mechanisms in a prospective randomized double-blind placebo-controlled intervention project in Sweden. Eur J Nutr. 2022 Sep;61(6):3135-3148.
Gong H, Yu Q, Guo D, Wang Y, Duan L, Huang W, Zhou J, Wang J, Huang P. The relationship between dietary selenium intake and telomere length among diabetes. Br J Nutr. 2022 Jun 10:1-7.
Miwa S, Kashyap S, Chini E, von Zglinicki T. Mitochondrial dysfunction in cell senescence and aging. J Clin Invest. 2022 Jul 1;132(13):e158447.
Opstad TB, Alexander J, Aaseth JO, Larsson A, Seljeflot I, Alehagen U. Selenium and Coenzyme q10 intervention prevents telomere attrition, with association to reduced cardiovascular mortality-sub-study of a randomized clinical trial. Nutrients. 2022 Aug 15;14(16):3346.Stoffaneller R, Morse NL. A review of dietary selenium intake and selenium status in Europe and the Middle East. Nutrients. 2015 Feb 27;7(3):1494-537.
Shu Y, Wu M, Yang S, Wang Y, Li H. Association of dietary selenium intake with telomere length in middle-aged and older adults. Clin Nutr. 2020 Oct;39(10):3086-3091.
Sturm G, Karan KR, Monzel AS, Santhanam B, Taivassalo T, Bris C, Ware SA, Cross M, Towheed A, Higgins-Chen A, McManus MJ, Cardenas A, Lin J, Epel ES, Rahman S, Vissing J, Grassi B, Levine M, Horvath S, Haller RG, Lenaers G, Wallace DC, St-Onge MP, Tavazoie S, Procaccio V, Kaufman BA, Seifert EL, Hirano M, Picard M. OxPhos defects cause hypermetabolism and reduce lifespan in cells and in patients with mitochondrial diseases. Commun Biol. 2023 Jan 12;6(1):22.
Wai KM, Umezaki M, Umemura M, Mar O, Watanabe C. Protective role of selenium in the shortening of telomere length in newborns induced by in utero heavy metal exposure. Environ Res. 2020 Apr;183:109202.
Wang L, Song L, Liu B, Zhang L, Wu M, Liu Y, Bi J, Yang S, Cao Z, Xia W, Li Y, Tian Y, Zhang B, Xu S, Zhou A, Wang Y. Association between maternal urinary selenium during pregnancy and newborn telomere length: results from a birth cohort study. Eur J Clin Nutr. 2022 May;76(5):716-721.
Winther KH, Rayman MP, Bonnema SJ, Hegedüs L. Selenium in thyroid disorders – essential knowledge for clinicians. Nat Rev Endocrinol. 2020 Mar;16(3):165-176.
Informationerne i denne artikel er ikke ment som lægehjælp og bør ikke fortolkes som sådan.
